



近日, 美國食品和藥物管理局(FDA)對來自中國的塑料注射器進口加強了監管,并計劃在必要時阻止中國制造的注射器進入美國。原因是擔心其質量問題可能影響醫療安全。
在去年11月收到了幾家中國注射器制造商的質量問題報告后,FDA首次建議消費者,醫護人員和醫療機構,“如果可能,考慮使用非中國制造的注射器”。
隨后分別對江蘇神力醫療產品有限公司、江蘇彩納醫療器械有限公司、浙江龍德醫藥有限公司和上海康德萊企業發展集團有限公司等多家中國制造商發布進口禁令。
截止2024年5月14日,采納和神力分別有190批和47批產品被拒絕入境,康德萊和龍德暫無拒絕入境記錄。
據共研網統計2017-2022年期間,我國一次性注射器年出口數量從138.68億個增加到202.89億個。
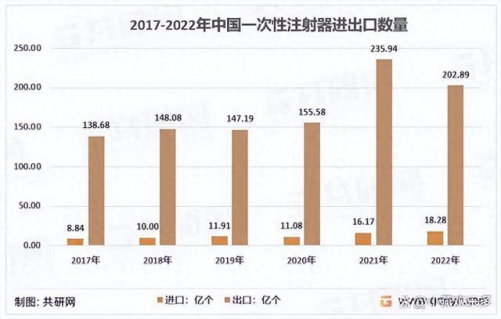
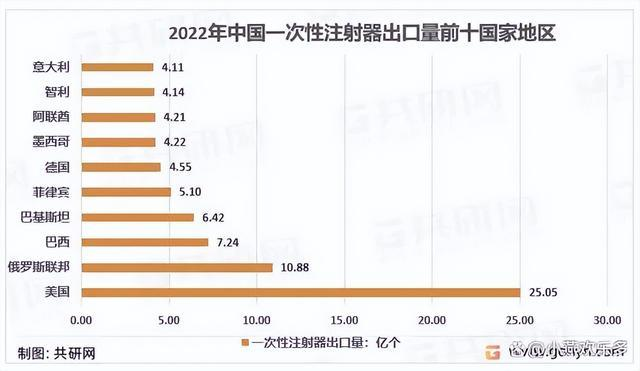
我國共向191個國家和地區出口一次性注射器,其中美國是壓倒性的海外第一大市場,22年向美國的出口量達到了25.05億個。
注射器事件始末
縱觀歷史,這還是FDA首次,對中國某個領域的所有制造商“開槍”。
而整件事情的起因,還要從2023年11月說起。彼時,FDA發布安全通知稱,收到了有關幾家中國注射器制造商的質量問題的信息,建議當地機構避開中國制造的塑料注射器。
2023年12月開始,FDA檢查員走訪在美國銷售分銷中國注射器的多家企業。其中包括Medline Industries和Sol-Millennium Medical的工廠。調查發現,這兩家企業不僅進口和銷售未經批準的中國制造的塑料注射器, 同時還有違反質量體系規定的行為。
今年3月18日,FDA就銷售和分銷未經批準的相關違規行為,向江蘇神力醫療、Medline Industries和Sol-Millennium Medical發出警告信。
根據信件內容,江蘇神力僅獲得了5mL luer-lock活塞注射器的 510(k) 認證,但卻向美國市場銷售了3、10、20、50和60毫升魯爾鎖定注射器。
此外,FDA 在給Medline Industries公司的警告信中還提到了江蘇采納醫療科技公司生產的塑料注射器的質量問題和性能測試失敗的問題。FDA 了解到,江蘇采納的幾款塑料注射器的性能測試顯示出現意外且無法解釋的故障。
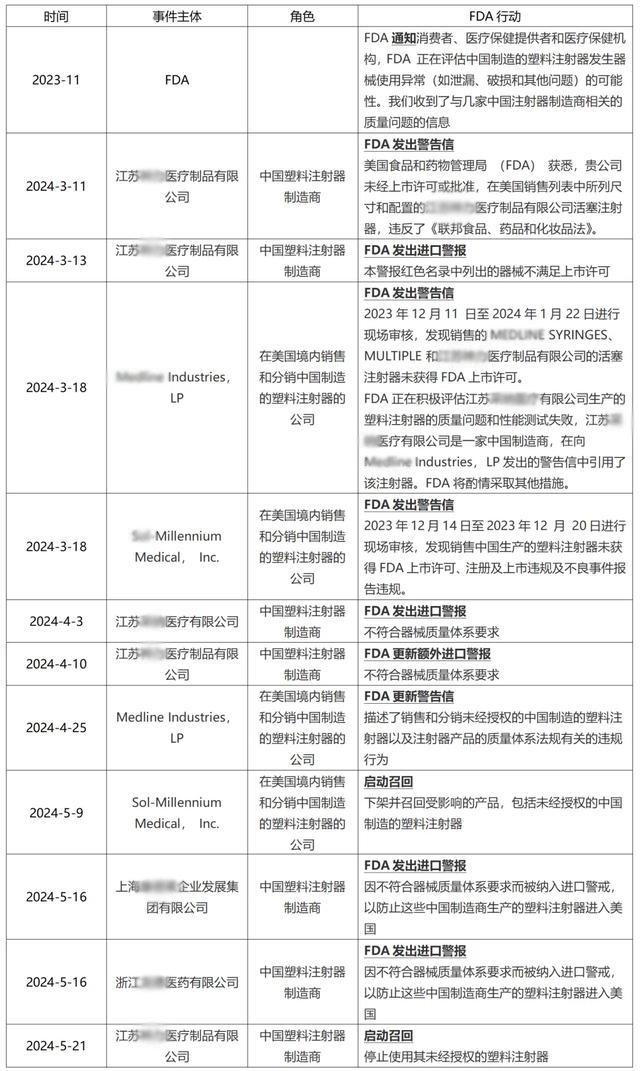
隨后,FDA擴大對江蘇神力的調查,并于4月向Cardinal發出警告。
據悉,Cardinal的手術包套組中涵蓋從Merit Medical采購的塑料注射器,而該產品正是由江蘇神力生產。Merit 在收到FDA的通知后,召回了這些套件。隨后Cardinal也召回了受影響的手術包產品。
醫療行業針對產品質量、用料、甚至生產環境、生產設備容器、都有嚴格的規定很多可能某一方面不符合就導致整個產品不符合質量安全要求。
質量是企業生命,誠信是企業根本
寶星作為一家專注醫療行業特種潤滑服務品牌商,協助客戶將產品質量及使用安全放在首位,針對一次性醫用耗材列如(醫用注射器、輸液器、醫用導管)根據工況需求提供全方位潤滑解決方案,有效解決醫用場景的產品部件在使用時造成的:卡頓、油脂與材料產生化學反應、耐高低溫、噪音異響、磨擦磨損、漏油甩油等造成產品使用體驗及安全問題。針對上述注射器案例已具有高效安全的潤滑解決方案,避免因某部件不符合醫療器械質量標準導致的不合格。寶星食品級醫用潤滑油符合FDA NSF食品級標準,通過生物相容性醫用安全認證,是醫用行業潤滑劑的最佳選擇。
